Doświadczenie 2.
1. Cel Doświadczenia:
Dysproporcjonowanie anionów MnO42- w środowisku kwasowym.
2. Lista odczynników:
K2MnO4(aq), H2SO4(aq)
lub lista tych związków bez indeksów dolnych plus dodatkowo H2O na samym końcu
K2MnO4, H2SO4, H2O
3. Poglądowy rysunek przeprowadzanego doświadczenia (przed i po):
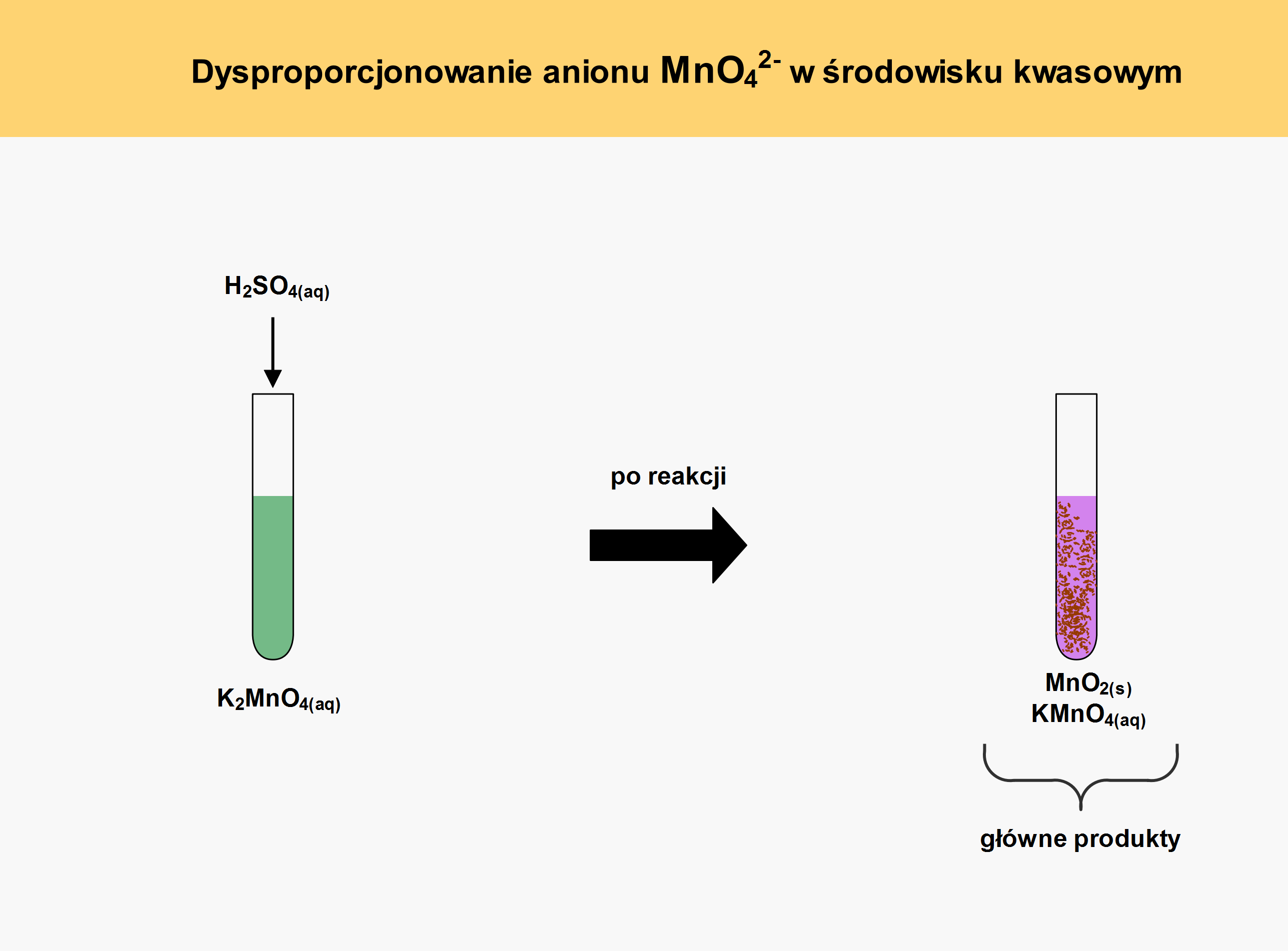
4. Opis wyglądu zawartości probówki przed dodaniem odczynnika oraz po zajściu reakcji chemicznej lub ten sam opis wyglądu, co na początku, gdy reakcja nie zachodzi.
| Wygląd zawartości probówki przed dodaniem odczynnika | Wygląd zawartości probówki po dodaniu odczynnika |
|
Zielony roztwór
|
Mieszanina niejednorodna – fioletowy roztwór i brunatny osad |
5. Obserwacje:
Zielony roztwór zmienia zabarwienie na fioletowy. Wytrąca się brunatny osad.
6. Równania reakcji (w formie cząsteczkowej i ewentualnie jonowej/jonowej skróconej:
Forma cząsteczkowa:
3K2MnO4 + 2H2SO4 → 2KMnO4 + MnO2 + 2K2SO4 + 2H2O
Równania połówkowe w formie jonowej:
MnO42- + 2e + 4H+ → MnO2 + 2H2O
MnO42- → MnO4– + e
Forma jonowa skrócona:
3MnO42- + 4H+ → 2MnO4– + MnO2 + 2H2O
7. Wnioski:
W roztworze wodnym w środowisku kwasowym jon MnO42- ulega dysproporcjonowaniu (dysmutacji) do MnO4– oraz MnO2.
8. Wskazówki praktyczne dla osoby wykonującej doświadczenie
- Zanieczyszczenia MnO2 na szkle (zarówno stare, jak i nowo powstałe) usuwać wodnym roztworem kwasu szczawiowego.

