Aby rozwinąć naciśnij czerwony znak + z prawej strony.
Ogólne wymagania i zasady oceniania CKE
- Co to jest kalkulator naukowy wg CKE?
Na podstawie:
Komunikat dyrektora Centralnej Komisji Egzaminacyjnej z 19 sierpnia 2022 r. w sprawie materiałów i przyborów pomocniczych, z których mogą korzystać zdający na egzaminie
ósmoklasisty i egzaminie maturalnym w 2023 roku:Kalkulator naukowy – jest to kalkulator, za pomocą którego zdający będzie mógł obliczyć: (1) wartości funkcji logarytmicznych (i odwrotnych do nich); (2) wartości funkcji trygonometrycznych (i odwrotnych do nich); (3) potęgi o dowolnym wykładniku rzeczywistym. Nie dopuszcza się możliwości korzystania na egzaminie z kalkulatora naukowego wyposażonego w technologie (np. Wi-Fi, Bluetooth) umożliwiające łączenie się z innym urządzeniem oraz z internetem lub programowanie. Kalkulator naukowy nie może być również wyposażony w technologie umożliwiające odtwarzanie i rejestrowanie obrazu i dźwięku.
- Czy zapisy strzałek: „↑”, „↓”,„⇄” w równaniach reakcji są wymagane na maturze?
Cytując Zasady oceniania rozwiązań zadań CKE:
- Zapis „↑”, „↓” w równaniach reakcji nie jest wymagany.
- W równaniach reakcji, w których ustala się stan równowagi, brak „⇄” nie powoduje utraty punktów.
- W równaniach reakcji, w których należy określić kierunek przemiany (np. reakcji redoks), zapis „⇄” zamiast „→” powoduje utratę punktów.
Znaczy to, że powyższe zapisy nie są wymagane. Można oczywiście używać powyższej symboliki pod warunkiem, że każdym razem użyjemy jej właściwie. Wstawienie jednej z powyższej strzałek w niewłaściwym miejscu będzie skutkować utratą punktu/ów. Dlatego daję Ci dobrą radę – stosuj tylko zapis „→” w równaniach reakcji.
- Czy we wzorach elektronowych mam symbolizować wolne pary elektronowe kropkami, czy kreskami?
Cytując Zasady oceniania rozwiązań zadań CKE:
- We wzorach elektronowych pary elektronowe mogą być przedstawione w formie kropkowej lub kreskowej.
- Czy jeśli w poleceniu jest: napisz wzór półstrukturalny, a ja napiszę wzór strukturalny, to strącę punkt?
Cytując Zasady oceniania rozwiązań zadań CKE:
Za napisanie wzorów strukturalnych zamiast wzorów półstrukturalnych (grupowych) nie odejmuje się punktów.
Musisz tylko pamiętać, że nie działa to w przeciwną stronę, tzn. jeśli w poleceniu będzie: napisz wzór strukturalny, a Ty napiszesz wzór półstrukturalny (grupowy) to utracisz punkt za to zadanie.
- Czy jeśli polecenie w zadaniu każe mi napisać wzór elektronowy, to muszę wskazywać kierunek spolaryzowania wiązań kowalencyjnych spolaryzowanych?
Jeśli nie ma w poleceniu wskazania kierunku spolaryzowania wiązań kowalencyjnych spolaryzowanych to nie stosuj tej symboliki.
Jeśli już chcesz być nadgorliwy, to Cytując Zasady oceniania rozwiązań zadań CKE:
Jeżeli we wzorze kreskowym zaznaczona jest polaryzacja wiązań, to jej kierunek musi być poprawny.
- Uwaga! W zasadach ocenieniach zmieniły się reguły związane z klasyfikowaniem pewnych błędnych wartości liczbowych. Niektóre z nich są traktowane jako BŁĄD METODY, a niektóre jako BŁĄD RACHUNKOWY!
Cytując Zasady oceniania rozwiązań zadań CKE:
- Zastosowanie błędnych wartości liczbowych wielkości niewymienionych w informacji wprowadzającej, treści zadania, poleceniu lub tablicach i niebędących wynikiem obliczeń należy traktować jako błąd metody.
- Zastosowanie błędnych wartości liczbowych wielkości podanych w informacji wprowadzającej, treści zadania, poleceniu lub tablicach należy traktować jako błąd rachunkowy, o ile nie zmienia to istoty analizowanego problemu, w szczególności nie powoduje jego uproszczenia.
- Użycie w obliczeniach błędnej wartości masy molowej uznaje się za błąd metody, chyba że zdający przedstawił sposób jej obliczenia – zgodny ze stechiometrią wzoru – jednoznacznie wskazujący wyłącznie na błąd rachunkowy.
- Czy na maturze wg podstawy 2023 będą obowiązywać w chemii organicznej tylko nazwy wg nowego systemu IUPAC od 2013?
Odpowiedź wprost od CKE (autor: Aleksandra Grabowska):
Uprzejmie informuję, że w przypadku zadań dotyczących nazewnictwa związków organicznych, dla których obowiązują nowe nazwy systematyczne, w 2023 r. na egzaminie maturalnym uznawane będą również poprawne nazwy utworzone wg obowiązujących poprzednio zasad.
- Czy zapisanie na maturze z lewej strony grupy metylowej jako CH3- zamiast H3C- jest błędne?
Cytując Zasady oceniania rozwiązań zadań CKE:
Wzór półstrukturalny (grupowy) lub uproszczony związku organicznego zawiera
informację, jakie grupy i w jakiej sekwencji tworzą cząsteczkę tego związku. W takim
wzorze dopuszcza się niezaznaczenie pojedynczego wiązania C–C i C–H oraz
sumaryczny zapis wzoru grupy etylowej C2H5– zamiast CH3–CH2–. Dopuszcza się także
każdy sumaryczny zapis wzoru grupy funkcyjnej, o ile jest jednoznaczny i nie sugeruje
istnienia wiązania między niewłaściwymi atomami (np. nie dopuszcza się dla grupy
hydroksylowej zapisu –HO zamiast poprawnego –OH, a dla grupy aldehydowej zapisu
–COH zamiast poprawnego –CHO). Ponadto dopuszcza się zapisy: CH3– zamiast H3C–,
NH2– zamiast H2N–. - Pełny tekst wszystkich, podstawowych, najnowszych Zasad oceniania rozwiązań znajdziesz poniżej
INFORMATOR o egzaminie maturalnym z chemii od roku szkolnego 2022/2023
Ogólne zasady oceniania
W zasadach oceniania zawarto przykłady poprawnych rozwiązań zadań otwartych. Te rozwiązania określają zakres merytoryczny odpowiedzi i nie muszą być ścisłym wzorcem oczekiwanych sformułowań (za wyjątkiem np. nazw, symboli pierwiastków, wzorów związków chemicznych). Akceptowane są wszystkie odpowiedzi merytorycznie poprawne i spełniające warunki zadania – również te nieprzewidziane jako przykładowe odpowiedzi w schematach punktowania.
- Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach.
- Gdy do jednego polecenia zdający podaje kilka odpowiedzi (spośród których jedna jest poprawna, a inne – błędne), nie otrzymuje punktów za żadną z nich. Jeżeli informacje zamieszczone w odpowiedzi (również dodatkowe, które nie wynikają z treści polecenia) świadczą o zasadniczych brakach w rozumieniu zagadnienia, którego dotyczy zadanie, i zaprzeczają udzielonej poprawnej odpowiedzi, to za taką odpowiedź zdający również nie otrzymuje punktów.
- W zadaniach wymagających sformułowania wypowiedzi, takiej jak wyjaśnienie, uzasadnienie, opis zmian możliwych do zaobserwowania w czasie doświadczenia, oprócz poprawności merytorycznej oceniana jest poprawność posługiwania się nomenklaturą chemiczną, umiejętne odwołanie się do materiału źródłowego, jeżeli taki został przedstawiony, oraz spójność, logika i klarowność toku rozumowania. Sformułowanie odpowiedzi niejasnej lub częściowo niezrozumiałej skutkuje utratą punktu (np. jeżeli zdający zamiast nazwy podmiotu stosuje zaimek, może uzyskać ocenę pozytywną tylko wtedy, gdy zaimek ten jednoznacznie odnosi się do właściwego podmiotu).
- W zadaniach, w których należy dokonać wyboru, każdą formę jednoznacznego wskazania (np. numer doświadczenia, wzory lub nazwy reagentów) należy uznać za poprawne rozwiązanie tego zadania, o ile podane wzory lub nazwy chemiczne nie zawierają błędu. Oznacza to, że np. podanie w odpowiedzi poprawnego wzoru zamiast nazwy nie skutkuje utratą punktu (mimo formalnej niezgodności z poleceniem), ale napisanie (lub przepisanie z treści zadania) błędnego wzoru lub nazwy – nawet jeżeli była podana w treści zadania – skutkuje utratą punktu.
- Rozwiązanie zadania na podstawie błędnego merytorycznie założenia uznaje się w całości za niepoprawne.
- Jeżeli polecenie brzmi: Napisz równanie reakcji w formie …, to w odpowiedzi zdający powinien napisać równanie reakcji w podanej formie z uwzględnieniem bilansu masy i ładunku. Za zapis równania reakcji ze współczynnikami ułamkowymi albo będącymi wielokrotnością współczynników najprostszych zdający nie traci punktu, o ile ten zapis spełnia warunki zadania. Za zapis równania reakcji, w którym poprawnie dobrano współczynniki stechiometryczne, ale nie uwzględniono warunków zadania (np. środowiska reakcji), zdający nie uzyskuje oceny pozytywnej.
Notacja chemiczna:
- We wszystkich typach wzorów chemicznych wymagających przedstawienia struktury cząsteczki substancji nieorganicznej lub organicznej (wzory strukturalne, szkieletowe, półstrukturalne, grupowe, uproszczone) oceniania jest poprawność wynikającej z ich zapisu wiązalności atomów oraz poprawność przedstawionej sekwencji atomów lub grup atomów. Wzory zapisane w sposób ignorujący wiązalność atomów (np. podstawnik obecny w cząsteczce związku organicznego łączący się wiązaniem z atomem wodoru zamiast z atomem węgla, z którym ten atom wodoru jest związany) oceniane są negatywnie.
- We wzorze strukturalnym należy zapisać symbole wszystkich atomów tworzących cząsteczkę i zaznaczyć kreską wszystkie wiązania występujące w cząsteczce z uwzględnieniem ich krotności. We wzorze strukturalnym nie wymaga się odwzorowania kształtu cząsteczki, czyli zachowania właściwych kątów między wiązaniami.
- Wzór szkieletowy związku organicznego jest odzwierciedleniem kształtu łańcucha węglowego. Nie zapisuje się w nim symboli atomów węgla i połączonych z nimi atomów wodoru, ale w postaci łamanej rysuje się szkielet węglowy, zaznaczając wiązania wielokrotne występujące w cząsteczce, i zapisuje się wzory grup funkcyjnych oraz symbole podstawników (atomów) innych niż wodór.
- Wzór półstrukturalny (grupowy) lub uproszczony związku organicznego zawiera informację, jakie grupy i w jakiej sekwencji tworzą cząsteczkę tego związku. W takim wzorze dopuszcza się niezaznaczenie pojedynczego wiązania C–C i C–H oraz sumaryczny zapis wzoru grupy etylowej C2H5– zamiast CH3–CH2–. Dopuszcza się także każdy sumaryczny zapis wzoru grupy funkcyjnej, o ile jest jednoznaczny i nie sugeruje istnienia wiązania między niewłaściwymi atomami (np. nie dopuszcza się dla grupy hydroksylowej zapisu –HO zamiast poprawnego –OH, a dla grupy aldehydowej zapisu –COH zamiast poprawnego –CHO). Ponadto dopuszcza się zapisy: CH3– zamiast H3C–, NH2– zamiast H2N–.
- We wzorach elektronowych elektrony mogą być przedstawiane w formie kropek, a pary elektronowe – również w formie kresek.
- Jeżeli we wzorze kreskowym zaznaczona jest polaryzacja wiązań, to jej kierunek musi być
- Za napisanie wzorów strukturalnych zamiast wzorów półstrukturalnych (grupowych) lub uproszczonych zdający nie traci punktów.
- Za napisanie wzorów elektronowych zamiast wzorów strukturalnych, półstrukturalnych (grupowych) lub uproszczonych zdający nie traci punktów.
- Zapis „↑”, „↓” w równaniach reakcji nie jest wymagany.
- W równaniach reakcji, w których ustala się stan równowagi, brak „⇄” nie powoduje utraty punktów.
- W równaniach reakcji, w których należy określić kierunek przemiany (np. reakcji redoks), zapis „⇄”, użyty zamiast zapisu „→”, powoduje utratę punktów.
Zadania zamknięte i zadania otwarte krótkiej odpowiedzi
Zadanie zamknięte i zadanie otwarte krótkiej odpowiedzi są oceniane – w zależności od maksymalnej liczby punktów, jaką można uzyskać za rozwiązanie danego zadania – zgodnie z poniższymi zasadami: 1 pkt – odpowiedź poprawna. 0 pkt – odpowiedź niepełna lub niepoprawna albo brak odpowiedzi. ALBO 2 pkt – odpowiedź całkowicie poprawna. 1 pkt – odpowiedź częściowo poprawna lub odpowiedź niepełna. 0 pkt – odpowiedź niepoprawna albo brak odpowiedzi.
Zadanie doświadczalne
W rozwiązaniach zadań doświadczalnych, w których zdający projektuje doświadczenie, należy wybrać oraz zaznaczyć właściwy odczynnik lub odczynniki z zaproponowanego zestawu, a następnie wykonać kolejne części polecenia, np. sformułować spostrzeżenia i wnioski lub napisać równania reakcji. Błędny wybór lub brak wyboru odczynników skutkuje utratą punktów nie tylko za tę czynnością, lecz także za odpowiedzi będące konsekwencją błędnego projektu doświadczenia albo jego braku.
Zadanie obliczeniowe
W rozwiązaniach zadań obliczeniowych są oceniane: metoda (przedstawiony tok rozumowania poprawnie wiążący wielkości dane z wielkością szukaną), wykonanie obliczeń i podanie wyniku z właściwą jednostką i odpowiednią dokładnością: 2 pkt – zastosowanie poprawnej metody, poprawne wykonanie obliczeń i podanie wyniku. 1 pkt – zastosowanie poprawnej metody, ale popełnienie błędów obliczeniowych lub podanie wyniku z błędną jednostką, lub z błędną dokładnością. 0 pkt – zastosowanie niepoprawnej metody albo brak rozwiązania. Poprawność wykonania obliczeń i wynik są oceniane pozytywnie tylko wtedy, gdy została zastosowana poprawna metoda rozwiązania. Oznacza to, że ocenę pozytywną zdający uzyskuje tylko za taką odpowiedź, na podstawie której można ocenić poprawność jego toku rozumowania. Nieprzedstawienie toku rozumowania skutkuje utratą punktów nawet wtedy, gdy zdający podał poprawne wyniki pośrednie i wynik końcowy. Wynik liczbowy wielkości mianowanej podany bez jednostki lub z niepoprawnym jej zapisem jest traktowany jako wynik błędny.
- Za rozwiązanie niedokończone, czyli takie, w którym nie przedstawiono związku miedzy wielkościami danymi a wielkością szukaną, zdający uzyskuje 0 punktów.
- Zastosowanie błędnych wartości liczbowych wielkości niewymienionych w informacji wprowadzającej, treści zadania, poleceniu lub tablicach i niebędących wynikiem obliczeń należy traktować jako błąd metody.
- Zastosowanie błędnych wartości liczbowych wielkości podanych w informacji wprowadzającej, treści zadania, poleceniu lub tablicach należy traktować jako błąd rachunkowy, o ile nie zmienia to istoty analizowanego problemu, a zwłaszcza nie powoduje jego uproszczenia.
- Za rozwiązanie, w którym popełniono błędy obliczeniowe, które w konsekwencji prowadzą do uproszczenia analizowanego problemu, zdający uzyskuje 0 punktów.
- Użycie w obliczeniach błędnej wartości masy molowej uznaje się za błąd metody, chyba że zdający przedstawił sposób jej obliczenia – zgodny ze stechiometrią wzoru – jednoznacznie wskazujący na błąd wyłącznie rachunkowy.
- Wynik liczbowy wielkości mianowanej należy wyrazić w takiej jednostce, jaka jest określona w poleceniu. Jeżeli w poleceniu nie jest sformułowany taki warunek, należy stosować jednostki układu SI lub jednostki zwyczajowo stosowane w polskiej literaturze, stężenie molowe roztworu wyraża się w jednostce mol ∙ dm-3 ,a masę molową – w jednostce g ∙ mol-1.
- W polskiej literaturze wielkości fizyczne zwyczajowo podawane są z trzema cyframi znaczącymi, co oznacza, że w notacji wykładniczej przyjmują postać: j,ds ∙ 10n (j oznacza jedności, d – części dziesiąte, s – części setne), np. stała Avogadra NA = 6,02·1023 cząstek ∙ mol-1, a objętość molowa gazu w warunkach normalnych Vmol = 22,4 dm ∙ mol-1 = 2,24 ∙ 101 dm ∙ mol-1. O ile nie precyzuje tego polecenie, wyniki pośrednie nie powinny być przybliżane bardziej niż do trzech cyfr znaczących, a wynik końcowy powinien być podany z trzema cyframi znaczącymi.
Zadanie problemowe
Zadanie problemowe, w którego rozwiązaniu można wyróżnić dwa kluczowe etapy, jest oceniane z zastosowaniem następujących poziomów rozwiązania (dla oceny maksymalnej równej 4 pkt):
Poziom 2. (3–4 pkt) Rozwiązanie zawierające oba etapy wykonane poprawnie co do metody: 4 pkt – jeżeli rozwiązanie nie zawiera usterek, np. błędów arytmetycznych. 3 pkt – jeżeli rozwiązanie zawiera usterki. Poziom 1. (1–2 pkt) Rozwiązanie zawierające pierwszy etap wykonany poprawnie co do metody. 2 pkt – jeżeli rozwiązanie nie zawiera usterek, np. błędów arytmetycznych. 1 pkt – jeżeli rozwiązanie zawiera usterki. Poziom 0. (0 pkt)
Rozwiązanie całkowicie błędne albo brak rozwiązania. W rozwiązaniach tego typu zadań zdający powinien przedstawić – w sposób zrozumiały dla osoby czytającej rozwiązanie – tok rozumowania prowadzący od wielkości podanych w treści zadania do wielkości szukanej wskazanej w poleceniu. Oznacza to, że w zapisie rozwiązania (niezależnie od zastosowanej metody) powinny zostać:
- jednoznacznie określone dane wykorzystane w obliczeniach
- przedstawione zależności między poszczególnymi wielkościami
- wyróżnione kolejne etapy rozwiązania
- wyróżnione wyniki kolejnych etapów rozwiązania i wyraźnie zaznaczony wynik końcowy (np. przez sformułowanie odpowiedzi lub podkreślenie wartości wielkości szukanej), którym jest wartość liczbowa wielkości szukanej wyrażona w odpowiedniej jednostce (o ile jest ona wielkością mianowaną) i z odpowiednią dokładnością (jeżeli została ona określona w poleceniu).
Budowa Materii (atom, wiązania, cząsteczki)
- Czy fluorowce (F2, Cl2, Br2, I2) tworzą w stanie stałym kryształy molekularne?
Tak, w odpowiednio niskiej temperaturze (a jod I2 już w temperaturze pokojowej): F2, Cl2, Br2 w stanie stałym tworzą kryształy molekularne, w których występują regularnie rozmieszczone cząsteczki, odpowiednio F2, Cl2, Br2 oraz I2 utrzymywane razem słabymi oddziaływaniami van der Waalsa.
- Czy oddziaływania van der Waalsa mają charakter niekierunkowy?
Zależy, o którą składową pytamy, bo na siły van der Waalsa składają się:
- siły Keesoma,
- siły Debye’a
- siły Londona.
Siły Keesoma (dipol trwały-dipol trwały) są względnie kierunkowe, siły Londona bezkierunkowe (ala wyindukowane pole elektryczne centralne) z dokładnością do fluktuacji kwantowych.
Chemia nieorganiczna (związki nieorganiczne, pierwiastki bloków s, p, d i ich właściwości)
- Czy w cząsteczce fluorowodoru występuje wiązanie jonowe? Bo tak by wskazywała różnica elektroujemności?
W ogólności w czystych postaciach kwasów tlenowych, jak i beztlenowych nie ma związków jonowych!!! (nie uwzględniamy tu polemiki, co do pewnych kwasów kompleksowych) Skala Elektroujemności wg Paulinga jest archaizmem, którego musicie się uczyć, jak wielu innych rzeczy, np. reakcji Wurtza, które w XXI w. nie mają żadnego znaczenia. Takie są niestety czasy. Dlatego też od razu zaznaczam, że w cząsteczkach dowolnych kwasów Arrheniusa są wyłącznie wiązania kowalencyjne spolaryzowane (mniej lub bardziej).
- Czy można powiedzieć, że NaOH jest solą wody?
Pojęcie soli wywodzi się z teorii Arrheniusa. Definicji IUPAC z Gold Book nie należy traktować poważnie, cytując: „A chemical compound consisting of an assembly of cations and anions”, bo oznaczałoby to, że wszystkie związki jonowe to sole. Nawet alkoholanów nie nazywa się solami, tylko związkami „typu soli”. A najbardziej szkodliwe dydaktycznie jest „wkręcanie” pojęcia soli do teorii Brønsteda. Nie ma czegoś takiego w teorii Brønsteda jak Sól. Tylko niektóre związki, które są powszechnie określane solami są jednocześnie „agregatami” kwas-zasada z punktu widzenia teorii Brønsteda. Jeszcze śmieszniej jest w innych teoriach kwasowo-zasadowych. Reasumując, napisz na maturze, że: „NaOH jest solą wody”, a masz ZERO gwarantowane.
- Może mi ktoś powiedzieć w jakich przypadkach w produktach piszemy NH3∙H2O a w jakich NH3+H2O, bo nie wiem czy to błąd jak napisze na odwrót, a w odpowiedziach jest różnie
Rozszerzona odpowiedź w poniższym artykule: https://chemiadlamaturzysty.pl/kwas-weglowy-kwas-siarkowyiv-woda-amoniakalna-tlenek-weglaiv-tlenek-siarkiiv-oraz-amoniak-w-chemii-oraz-w-zadaniach-maturalnych/
- Czy rozpisujemy hydrolizę osadów ?
Domyślnie, bez informacji wstępnej nie spotkasz się z takim zadaniem na maturze. Jeśli jednak Cię to interesuje, to trzeba tutaj zaznaczyć, że mała ilość tzw. trudno rozpuszczalnej soli ulegnie rozpuszczeniu i podlega wszystkim prawom, którym podlegają sole łatwo rozpuszczalne w wodzie, a więc np. hydrolizie. Należy przy tym pamiętać (prawdopodobnie chodzi o CaCO3), że różne fazy krystaliczne mają różne właściwości fizykochemiczne – oznacza to mniej więcej tyle, że jeżeli masz w kuchni blat marmurowy (główny składnik CaCO3), to jak wylejesz na niego wodno-alkoholowy roztwór fenoloftaleiny to nie zabarwi się on na malinowy kolor. Jednak jak wykazano eksperymentalnie dodatek wodno-alkoholowego roztworu fenoloftaleiny do nasyconego, wodnego roztworu CaCO3(aq) pozostającego w równowadze z osadem CaCO3(s) zabarwia zawartość probówki na różowo.
- Które z metali pasywujących się w stężonych roztworach kwasów utleniających na zimno trzeba znać na maturę?
Trzeba znać żelazo Fe oraz glin Al. Pomimo braku info o chromie moim zdaniem warto jeszcze dorzucić sobie chrom 🙂
Stopień utlenienia i reakcje redoks
- Napisać pytanie
Napisać odpowiedź
Elektrochemia (półogniwa, ogniwa, korozja, elektroliza)
- Czy ogniwo podczas pracy rozładowuje się?Tutaj trzeba doprecyzować pytanie, bo można je odczytać dwojako:– czy ogniwo podczas pracy (zasilanie urządzenia) rozładowuje się? Odpowiedź brzmi: Tak, to jest chyba oczywiste,– czy ogniwo w obwodzie otwartym rozładowuje się samoistnie? Tutaj odpowiedź jest również twierdząca i stanowi jedną z cech i parametrów, jakie się podaje dla dowolnego ogniwa (samorozładowanie).
Kinetyka chemiczna
- Czy wzrost temperatury zwiększa szybkość reakcji endotermicznej, a zmniejsza endotermicznej?
Wzrost temperatury powoduje zawsze zwiększenie częstotliwości zderzeń się ze sobą drobin (cząsteczek/atomów), a więc zwiększa również częstotliwość zderzeń efektywnych czyli zwiększa szybkość KAŻDEJ REAKCJI, niezależnie od jej efektu energetycznego. Przy czym dla reakcji, w których ustala się wyraźny stan równowagi wzrost szybkości reakcji endo jest znacznie większy niż reakcji egzo. Wyjątki bez informacji wstępnej Was nie powinny interesować!
Równowaga chemiczna
- Czy jest różnica między wyrażeniem stężenia molowego w nawiasie kwadratowym, np. [X], a wyrażeniem jako Cx z indeksem dolnym?
Wyrażenia w nawiasach kwadratowych są liczbowymi wartościami stężeń molowych, aby użyte w wyrażeniach na stężeniowe stałe równowag „dawały” stałe Kc jako wartości niemianowane. Stężenia wyrażone literką C to już „pełnoprawne” stężenia molowe, wyrażające wartość liczbową i jednostkę mol/dm3. Jeśli przez X oznaczymy pewną substancję, której wartość stężenia molowego, np. 2,5 jest obecna w jakimś wyrażeniu na stałą równowagi to:
[X] = Cx/Co
gdzie Co – umowne standardowe stężenie molowe równe 1 mol/dm3.
Tak więc:
Cx = 2,5 mol/dm3
Co = 1 mol/dm3
[X] = Cx/Co = (2,5 mol/dm3)/(1 mol/dm3) = 2,5 (bez jednostki)
Podsumowując, oznaczenia [X] powinny być używane w wyrażeniach na stałe równowag, a Cx we wszystkich innych przypadkach, np. w równaniu kinetycznym, zadaniach obliczeniowych, gdzie oblicza się np. stężenie molowe itp.
- Czy dysocjacje kwasów powinno się pisać z powstaniem H3O+?
Jeśli mamy na myśli dysocjację elektrolityczną w roztworach wodnych to forma z powstającym H3O+ jest bardziej prawidłową formą niż forma z H+. Jednak, jeśli zadanie nie ma kontekstu teorii Brønsteda, albo już w nim znajdują się zapisy z H+ to obie formy powinny być zaliczane.
- Kiedy kwas jest słaby? (Jak stopień dysocjacji jest mniejszy niż 5% i czy jakaś stała też ? )
Nie ma ścisłej definicji mocnych/słabych kwasów w kontekście Arrheniusa. Nawet książkowa definicja mocnych kwasów jest naciągana (nie tylko w roztworach wodnych). Ponieważ stopień dysocjacji kwasu słabego rośnie wraz z rozcieńczeniem, osiągając w granicznym przypadku alfa = 100% (słaby kwas staje się „mocnym”), to widać, że co najmniej w definicji książkowej należałoby coś zmienić. W renomowanych czasopismach edukacyjnych wielu autorów przedstawiało swoje propozycję zero-jedynkowego podziału na mocne i słabe kwasy (ja też swoją miałem opartą na matematycznej pochodnej – zdrowo pojechałem z analizą w szerokim zakresie stężeń
 ), ale nigdzie na świecie nie zainteresowało się tym grono pedagogów. Zostawiając bezużyteczną definicję książkową (mocny kwas, to taki, który w niezbyt stężonym roztworze jest całkowicie zdysocjowany na jony) zapamiętaj listę arbitralnie przyjętych mocnych kwasów, a reszta „pospolitych” kwasów to kwasy słabe.
), ale nigdzie na świecie nie zainteresowało się tym grono pedagogów. Zostawiając bezużyteczną definicję książkową (mocny kwas, to taki, który w niezbyt stężonym roztworze jest całkowicie zdysocjowany na jony) zapamiętaj listę arbitralnie przyjętych mocnych kwasów, a reszta „pospolitych” kwasów to kwasy słabe.
Chemia organiczna
- Czy tylko alkohole posiadające w swej strukturze dwie grupy hydroksylowe -OH przy sąsiednich (wicynalnych), alifatycznych atomach węgla ulegają tej próbie, w której następuje roztwarzanie niebieskiego, galaretowatego osadu Cu(OH)2? dają szafirowy, klarowny roztwór?
Tak, wśród związków alifatycznych i nasyconych tylko dwie grupy hydroksylowe we względnej pozycji 1,2-diol tworzą z Cu(OH)2 w środowisku alkalicznym trwałe, szafirowe, klarowne roztwory. 1-3-diole-, 1,4-diole-, oraz inne nie dają pozytywnego wyniku tej próby. Nawet pozytywnego wyniku tej próby nie dają niektóre enodiole, np. Witamina C, która wykazuje silniejsze właściwości redukujące. Pozytywnego wyniku tej próby nie daje też o-hydroksyfenol. Sprawdzone eksperymentalnie!
- Czy ketony odbarwiają wodny roztwór manganianu(VII)?
W łagodnych warunkach, tj. nawet gorący KMnO4/H+ czy K2Cr2O7/H+, nie reaguje z ketonami, które nie posiadają innych grup funkcyjnych. W związku z powyższym, wodny (nawet zakwaszony) roztwór KMnO4 nie odbarwia się w wodnych roztworach ketonów.
- Dlaczego wśród izomerycznych amin i amidów (nieposiadających dodatkowych ugrupowań w strukturze) III-rzędowe aminy oraz amidy mają niższe temperatury wrzenia?
W strukturach III-rzędowych amin i amidów nie ma atomów wodoru przyłączonych do silnie elektroujemnego atomu azotu, stąd nie mogą one tworzyć pomiędzy własnymi cząsteczkami wiązań wodorowych (tylko słabe oddziaływania van der Waalsa). W odróżnieniu od nich, pomiędzy cząsteczkami I i II-rzędowych amin i amidów ze względu na obecność wiązania N-H mogą się tworzyć międzycząsteczkowe wiązania wodorowe, stąd izomeryczne I- i II-rzędowe aminy i amidy mają wyższe temperatury wrzenia.
- Jaki odczyn mają wodne roztwory estrów?
Wodne roztwory estrów (tych, które w wodzie rozpuszczają się „w miarę” dobrze) mają odczyn obojętny, o ile nie posiadają w strukturze dodatkowych ugrupowań typu grupa karboksylowa, ugrupowanie fenolowe (i inne kwasowe). Czyli np. wodny, nasycony roztwór metanianu metylu ma odczyn obojętny.
- Czy w reakcji wodorotlenku miedzi(II) z kwasem metanowym (mrówkowym) otrzymamy ceglastoczerwony osad tlenku miedzi(I)?
Odpowiedź brzmi: NIE
Wodorotlenek miedzi(II)jak każdy inny wodorotlenek reaguje z tym, czy z innymi kwasami dając odpowiednią sól, w tym wypadku metanian miedzi(II) (mrówczan miedzi(II).
Cu(OH)2 + 2HCOOH → Cu(HCOO)2 + 2H2O
LUB
Cu(OH)2 + 2HCOOH → (HCOO)2Cu + 2H2O
Poniższe zdjęcie przedstawia mrówczan miedzi(II) w formie stałej, jak i wodny roztwór tego związku (praca własna):

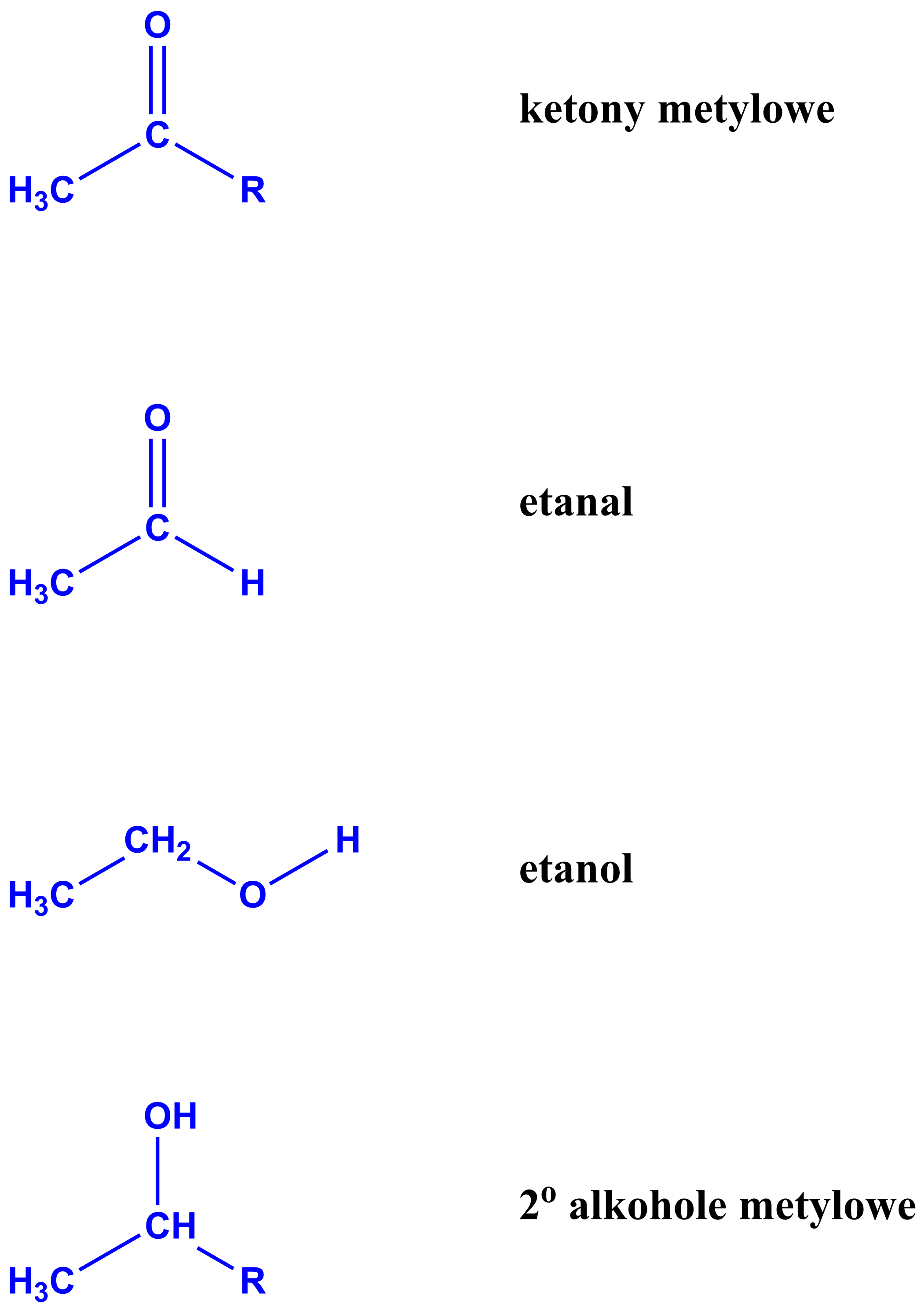
- Które związki organiczne dają pozytywny wynik próby jodoformowej?
Pozytywny wynik próby jodoformowej (pozytywny bezpośredni lub pośredni) dają:
ketony metylowe
etanal
etanol
drugorzędowe alkohole metylowe
(R – to grupa węglowodorowa, a nie atom wodoru)
- Czy w reakcji fenolanu sodu z wodnym wodnym roztworem FeCl3 też powstanie fioletowy kompleks?
Odpowiedź: NIE
Ze względu na silną hydrolizę anionu fenolanowego i bardzo małą wartość Kso dla Fe(OH)3 we wspomnianej reakcji wytrąci się brunatny osad wodorotlenku żelaza(III) (patrz fotografia poniżej, po lewej tytułowa reakcja, po prawej wzorcowy kompleks: fenol + FeCl3):

Inne
- Czy żółty niekopcący płomień to spalanie całkowite czy niecałkowite ?
Pomijając wpływ obcych atomów na własności spektralne widma emisyjnego płomienia, oczami raczej nie odróżnisz analitycznie po kolorze płomienia, czy związek organiczny spala się tam do CO2, czy CO.
Znalazłeś jakiś błąd? Napisz, autor nie gryzie 🙂 (kontakt@chemiadlamaturzysty.pl)
